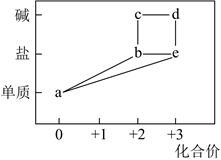
1.
某氯化铁样品含有少量FeCl2杂质.现要测定其中铁元素的质量分数,实验按以下步骤进行:

随着能源问题的进一步突出,利用热化学循环制氢的研究受到许多发达国家的青睐.最近的研究发现,复合氧化物铁酸锰(MnFe2O4)也可以用于热化学循环分解水制氢,MnFe2O4的制备流程如下:
(1)原料Fe(NO3)n中n= ,投入原料Fe(NO3)n和Mn(NO3)2的物质的量之比为 .
(2)步骤二中连续搅拌的目的是: ,步骤三中洗涤干净的标准是 .
(3)利用MnFe2O4热化学循环制氢的反应可表示为:
MnFe2O4MnFe2O4﹣x+
O2↑,MnFe2O4﹣x+xH2O→MnFe2O4+xH2↑
请认真回答下列问题:
①若MnFe2O4﹣x中x=0.8,则MnFe2O4﹣x中Fe2+占全部铁元素的百分率为:
②该化学循环制氢的优点是:
③该化学循环法制氢尚有不足之处,进一步改进的研究方向是:
【考点】
铁盐和亚铁盐的相互转变;
基础巩固
能力提升
变式训练
拓展培优
真题演练