1.
利用Cl2氧化绿色K2MnO4浓强碱溶液制备KMnO4的装置如下图所示(加热、夹持装置略):
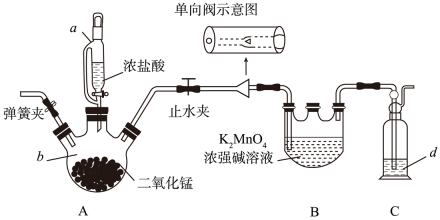
(1)
仪器b的名称为,d中的溶液是。实验开始前向仪器a中加入水,盖好玻璃塞,关闭止水夹和弹簧夹,打开仪器a玻璃旋塞向b中滴加水,一段时间后看水能不能滴下,此操作(填“能”或“不能”)检验装置的气密性。
(2)
装置B中Cl2氧化K2MnO4的化学方程式为。
(3)
单向阀的作用是, 当仪器B中即停止通氯气。
(4)
当B中反应结束,后续操作是熄灭A处酒精灯,待冷却后拆除装置。
(5)
锰酸钾(K2MnO4) 在浓强碱溶液中可稳定存在,碱性减弱时易发生反应:  +MnO2↓+4OH-根据此信息,可以得出上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是。
(6)
某兴趣小组同学用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某过氧化氢试样,反应原理为2
+MnO2↓+4OH-根据此信息,可以得出上述装置存在一处缺陷,会导致KMnO4产率降低,改进的方法是。
(6)
某兴趣小组同学用0.1000 mol·L-1的酸性高锰酸钾标准溶液滴定某过氧化氢试样,反应原理为2 + 5H2O2 + 6H+ =2Mn2+ + 8H2O+5O2↑。用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
+ 5H2O2 + 6H+ =2Mn2+ + 8H2O+5O2↑。用移液管移取25.00 mL试样置于锥形瓶中,重复滴定四次,每次消耗酸性高锰酸钾标准溶液的体积如表所示:
第一次 | 第二次 | 第三次 | 第四次 | |
17.30 | 17.90 | 18.00 | 18.10 |
计算试样中过氧化氢的浓度为mol·L-1 .
【考点】
制备实验方案的设计;
能力提升
真题演练






 图2
图2





