1.
某化学小组同学利用一定浓度的H2O2溶液制备O2 , 再用O2氧化C2H5OH,并检验氧化产物。
(1)
Ⅰ.制备O2
(2)
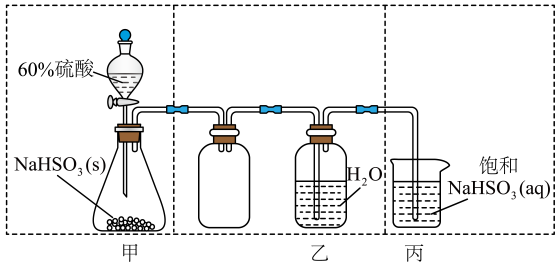
乙装置中,用粘合剂将MnO2制成团,放在多孔塑料片上,连接好装置,气密性良好后打开活塞K1 , 经长颈漏斗向试管中缓慢加入3% H2O2溶液至。欲使反应停止,关闭活塞K1即可,此时装置中的现象是。
(3)
丙装置可用于制备较多O2 , 催化剂铂丝可上下移动。制备过程中如果体系内压强过大,安全管中的现象是,此时可以将铂丝抽离H2O2溶液,还可以采取的安全措施是。
(4)
丙装置的特点是(填序号)。
(5)
Ⅱ.氧化C2H5OH
(6)
Ⅲ.检验产物
该小组同学设计了如下气体发生装置(夹持装置省略)

甲装置中主要仪器的名称为。
a.可以控制制备反应的开始和结束
b.可通过调节催化剂与液体接触的面积来控制反应的速率
c.与乙装置相比,产物中的O2含量高、杂质种类少
该小组同学设计的氧化C2H5OH的装置如图(夹持装置省略)
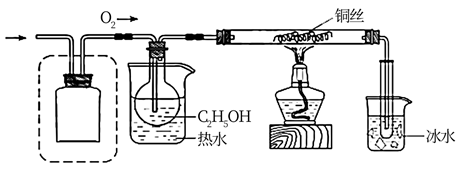
在图中方框内补全干燥装置和干燥剂。
为检验上述实验收集到的产物,该小组同学进行了如下实验并得出相应结论。
|
实验序号 |
检验试剂和反应条件 |
现象 |
结论 |
|
① |
酸性KMnO4溶液 |
紫红色褪去 |
产物含有乙醛 |
|
② |
新制Cu(OH)2 , 加热 |
生成砖红色沉淀 |
产物含有乙醛 |
|
③ |
微红色含酚酞的NaOH溶液 |
微红色褪去 |
产物可能含有乙酸 |
实验①~③中的结论不合理的是(填序号),原因是。
【考点】
制备实验方案的设计;
能力提升
真题演练






 图2
图2