一、选择题(共17题,共34分)
11.
(2022·邯郸模拟)下列除杂试剂和分离方法都正确的是( )
选项 | 物质(括号内为杂质) | 除杂试剂 | 分离方法 |
A | 澄清石灰水 | 过滤 | |
B | 饱和 | 洗气 | |
C |
| 加热 | |
D | 饱和 | 分液 |
A.
A
B.
B
C.
C
D.
D
二、非选择题(共18题,共138分)




 +CO2↑+H2O
+CO2↑+H2O









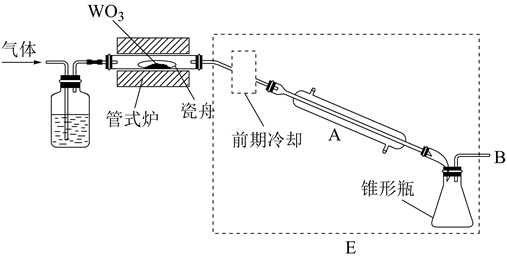











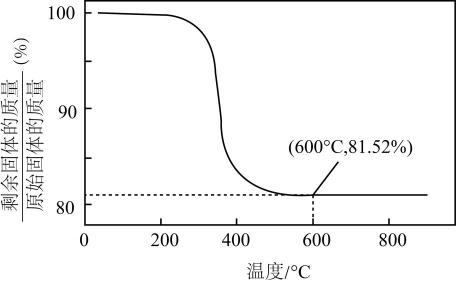















 已知:①
已知:①
