1.
氯化铜和氯化亚铜都是重要的化工原料,常用作石油工业脱臭脱硫和纯化剂、印染媒染剂等。某研究小组用粗铜( 含杂质Fe) 为原料制备CuCl2·2H2O晶体,再用CuCl2·2H2O晶体制各CuCl。
[制备CuCl2·2H2O晶体]

(1)
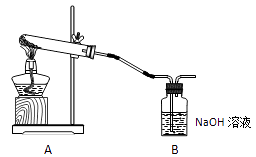
仪器B的名称是;B中反应的离子方程式为。
(2)
装置C中粗铜粉末与气体充分反应时的生成物是(填化学式)。反应完成后,将C中的固体用稀盐酸完全溶解、再加入试剂M除杂,经一系列操作便可获得CuCl2·2H2O晶体。
(3)
[制备CuCl 固体]
(4)
为测定CuCl固体的产率,进行如下定量分析:
①试剂M应当选用(填符合题意答案字母编号)
a.Cu(NO3)2 b.NaOH c.CuO d.NH3·H2O e.Cu(OH)2
②溶解C中生成物固体时,有时会加入少量双氧水,目的是。
③设计简易实验方案确定所CuCl2·2H2O晶体中不含铁化合物:。
将CuCl2·2H2O晶体在HCl气流中加热到140℃得无水CuCl2 , 再加热到300℃以上可获得CuCl固体。
将CuCl2·2H2O晶体在HCl气流中加热脱水的原因是。①将10.26gCuCl2·2H2O晶体先加热到140℃,再加热到300℃以上,充分反应后,将所得固体平均三份,分别转移至三个锥形瓶中。
②分别在三个锥形瓶中加过量FeCl3溶液不断振荡,使固体迅速溶解,再加入2滴1,10—邻菲啰啉一硫酸亚铁络合物作指示剂。
③用1.00mol/L的硫酸铈[Ce(SO4)2]标准液进行滴定。平行测定三份样品溶液,消耗硫酸铈[Ce(SO4)2]标准溶液的平均体积为19.40mL。
反应原理: CuCl+ FeCl3=CuCl2+FeCl2 , Fe2++Ce4+=Ce3++Fe3+
根据上述定量实验计算CuCl的产率为。
【考点】
氯气的化学性质;
氯气的实验室制法;
能力提升
真题演练