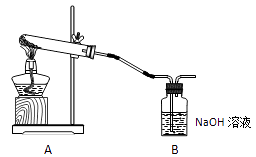
1.
实验室常用如下装置所示方法制备氯气:

(1)
1molMnO2和4mol浓盐酸制得的氯气的产量往往远低于1mol,原因可能是;
(2)
若改用NaCl固体、浓硫酸和MnO2一起加热,理论上氯元素利用率可以达到100%,试用化学反应方程式表示原因;
(3)
若在分液漏斗下方接一段毛细管插入圆底烧瓶底部,不需加热也可获得均匀稳定干燥的氯化氢气流,则分液漏斗和圆底烧瓶中应该盛放的试剂分别是。
【考点】
氯气的化学性质;
氯气的实验室制法;
能力提升
真题演练