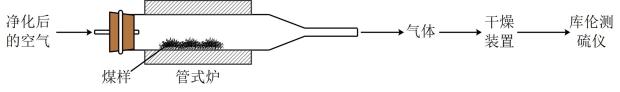
1.
维生素C是一种水溶性维生素,有强还原性、水溶液显酸性。化学式为 。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
。某小组同学测定了某新鲜水果中维生素C的含量,实验报告如下:
【实验目的】测定某新鲜水果中维生素C的含量。
【实验原理】 ,
。
【实验用品】标准溶液、指示剂、
溶液、
溶液、蒸馏水等。
【实验步骤】
(1)
配制待测溶液:称取新鲜水果样品 , 加入适量蒸馏水进行粉碎、过滤,并将滤液转移至
, 加入适量蒸馏水进行粉碎、过滤,并将滤液转移至 容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(填“酸式”或“碱式”)滴定管盛装。
(2)
氧化还原滴定法:取(1)中配制好的待测溶液
容量瓶中,定容,随后将待测溶液加到滴定管中。根据维生素C的性质,待测溶液应用(填“酸式”或“碱式”)滴定管盛装。
(2)
氧化还原滴定法:取(1)中配制好的待测溶液 于锥形瓶中,调节
于锥形瓶中,调节 至3,加入适量指示剂后,小心地滴入
至3,加入适量指示剂后,小心地滴入 标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素
标准溶液,直至滴定终点,记录相关数据。平行测定三次,计算新鲜水果中维生素 的质量分数。
(3)
库仑滴定法:取(1)中配制好的待测溶液
的质量分数。
(3)
库仑滴定法:取(1)中配制好的待测溶液 , 用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
, 用库仑仪测定其中维生素C的含量。平行测定三次,计算新鲜水果中维生素C的质量分数。
①上述氧化还原滴定法应用作指示剂,滴定终点的现象为。
②除了样品的质量、待测溶液的体积外,计算新鲜水果中维生素C的质量分数还需要的数据有。
已知:库仑仪中电解原理示意图如下。检测前,电解质溶液中保持定值时,电解池不工作。将待测溶液加入电解池后,维生素C将
还原,库仑仪便立即自动进行电解到
又回到原定值,测定结束,通过测定电解消托的电量可以求得维生素C的含量。

①库仑仪工作时电解池的阳极反应式为。
②若电解消耗的电量为Q库仑,维生素C的摩尔质量为 , 则新鲜水果中维生素C的质量分数为。(用含
的代数式表示)已知:电解中转移
电子所消耗的电量为96500库仑。
③测定过程中,需控制电解质溶液 , 当
时,部分
易被空气中的
直接氧化为
, 该过程的离子方程式为。这部分非电解生成的
;将导致测得的维生素C的含量。(填“偏大”或“偏小”)。
【考点】
探究物质的组成或测量物质的含量;
电解池工作原理及应用;
能力提升
真题演练