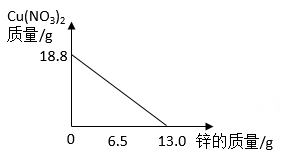
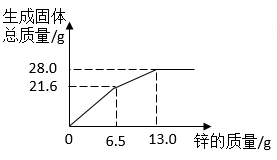
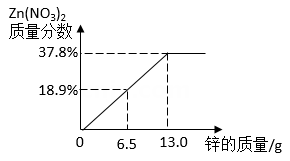
1.
将铁粉和稀硫酸先后加入到一定量的硫酸铜溶液中,搅拌使之充分反应。实验过程中,加入物质的质量与烧杯中剩余固体的质量关系如图所示。
(1)a点时剩余的固体物质是(填化学式)。
(2)n点对应的横坐标数值是。
(3)实验过程中共产生FeSO4多少克?

(4)模型能够直观反映化学变化的结果。将一定质量的镁条放入某一溶液(如图),其溶质硫酸铜和硫酸亚铁的质量相同,充分反应后烧杯内固体的组成和质量大小关系不可能的是。

【考点】
根据化学反应方程式的计算;
金属的化学性质;
基础巩固
能力提升
变式训练
拓展培优
真题演练