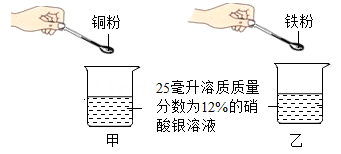
1.
分别向两份装有等质量的镁粉和铁粉的烧杯中逐渐加入等浓度的稀硫酸直至过量,下列图像中正确的是( )
A.
 B.
B.
 C.
C.
 D.
D.

 B.
B.
 C.
C.
 D.
D.

【考点】
根据化学反应方程式的计算;
金属的化学性质;