1.
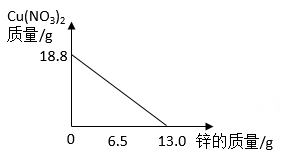
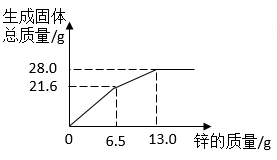
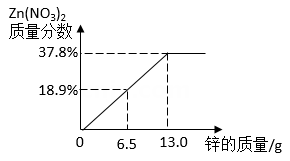
实验室有一瓶碳酸钙和氯化钙粉末组成的均匀混合物,小科用相同溶质量的稀盐酸和不同质量的该混合物反应(所得溶液均为不饱和溶液),四组实验数据记录如下表
实验组别 | 一 | 二 | 三 | 四 |
稀盐酸质量/克 | 100.0 | 100.0 | 100.0 | 100.0 |
混合物质/克 | 3.0 | 6.0 | 9.0 | 12.0 |
所得溶液质量/克 | 101.9 | 103.8 | 105.0 | a |
剩余固体质量/克 | 0 | 0 | >0 | >0 |
已知氯化钙溶液为中性,请回答:
(1)向第一组反应后所得溶液中加3克氯化钙粉末,溶液的质量会。(填“变大”、“不变”或“变小”)
(2)判断第三组别中稀盐酸是否有剩余,请说明理由。
(3)求混合物中碳酸钙的质量分数?
(4)表中a的值为。
【考点】
根据化学反应方程式的计算;
基础巩固
能力提升
变式训练
拓展培优
真题演练