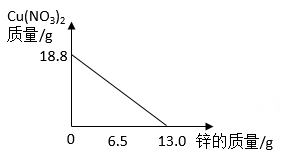
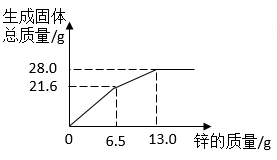
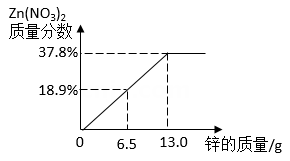
1.
赤铁矿的主要成分为氧化铁,可用于炼铁。某地出产一种赤铁矿,其中含氧化铁的质量分数为64%,90吨该赤铁矿经过充分冶炼,最多可生产含铁96%的生铁多少吨?
【考点】
根据化学反应方程式的计算;
能力提升
变式训练
拓展培优
真题演练