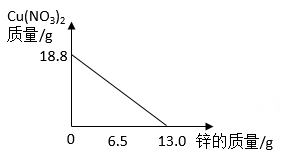
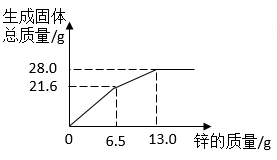
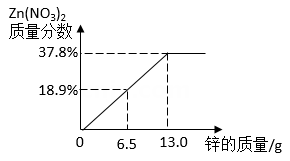
1.
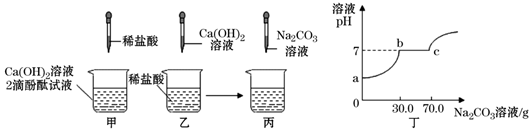
在用稀盐酸和氢氧化钡溶液进行中和反应实验时,反应过程中溶液酸碱度变化及相关数据如图所示。

(1)根据此变化曲线,你认为实验操作是将滴加到另一种溶液中
(2)当加入溶液的质量是a克时,滴入无色酚酞试液,溶液呈色,此时溶液中溶质是(写化学式)
(3)求恰好完全反应时溶液中溶质的质量 (需写出计算过程)
【考点】
根据化学反应方程式的计算;
基础巩固
能力提升
变式训练
拓展培优
真题演练