1.
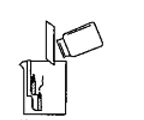
学习了酸雨及酸的性质后,壹壹知道了煤燃烧会产生二氧化硫、二氧化碳和水蒸气等气体,其中二氧化硫是形成酸雨的主要原因之一。壹壹在老师指导下制作了“酸雨形成及危害的模型”来研究酸雨形成的原因及危害,并设计了评价表。如下图所示是壹壹制作的模型。
评价指标 | “酸雨形成及危害的模型”评价量表 | ||
优秀 | 合格 | 待改进 | |
指标 一 | 密封性好,能除去大部分污染气体 | 密封性好,能除去小部分污染气体 | 密封性不好,不能除去污染气体 |
指标 二 | 能通过实验现象说明煤燃烧产生的气体是SO2 | 有实验现象,但不能说明煤燃烧产生SO2 | 没有明显实验现象 |
(1)实验中,壹壹认为紫色石蕊试液不能用酚酞试液替代,理由是:。
(2)根据评价量表,该模型的指标一可被评为优秀。因为该装置可以除去大部分污染气体,原因是。
(3)请评价该模型的指标二的等级,并说明理由:。

【考点】
二氧化碳的化学性质;