1.
I.常温下,向含
的废水(其他离子和
均不反应)中加入
的盐酸,生成
沉淀。已知该温度下,
,
, 忽略混合后溶液体积的变化。
(1)反应后,溶液中。
(2)取适量生成的AgCl沉淀于试管中,滴加足量溶液,写出相应的实验现象:。
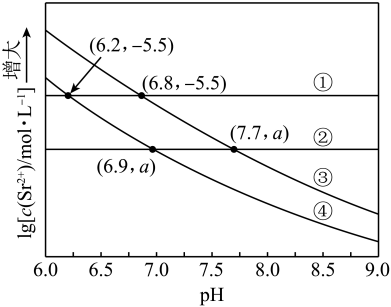
该温度下,加水稀释饱和溶液(稀释后仍有固体存在),回答以下问题:
(3)稀释过程中,的沉淀溶解平衡的移动方向为:。
A.正向移动 B.逆向移动 C.不移动
(4)稀释过程中,如何变化?。
A.变大 B.变小 C.不变
II.常温下,通过调节溶液值对某工业废水(含
、
和
, 且浓度均为
)进行处理。溶液中金属离子开始沉淀和完全沉淀的
如下表所示:
物质 | |||
开始沉淀( | 2.2 | 5.2 | 7.5 |
沉淀完全( | 3.2 | 6.7 | 9.0 |
(5)利用上述表格数据,计算的
。(保留两位有效数字)
(6)某小组设计从该废水中回收利用铜资源,流程如图所示,通入适量氯气的目的是:;调节溶液的时可以加入(填化学式),应控制
值的范围为。

III.我国《生活饮用水卫生标准》中规定生活用水中镉的排放量不超过。处理含镉废水可采用化学沉淀法。已知一些化合物在常温时的
如表:
化合物 | CdS | ||
(7)写出磷酸镉[]溶度积常数的表达式:
=。
(8)室温下,和
的饱和溶液中
浓度较大的是。
A. B.
(9)向某含镉废水中加入 , 当
浓度达到
时,判断此时是否符合《生活饮用水卫生标准》并写出计算过程。(填“是”或“否”)。写出计算过程。
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;
基础巩固
能力提升
变式训练
拓展培优
真题演练