1.
硫酸铁在化学实验中应用广泛。某小组利用硫酸铁进行如下实验:
实验(一)测定Fe和发生归中反应的反应热。
(1)
配制 溶液。称取一定量
溶液。称取一定量 固体溶于适量硫酸溶液中,加水稀释至250mL。下列仪器中,完成本实验一定不需要选择的是(填字母)。
(2)
为测定
固体溶于适量硫酸溶液中,加水稀释至250mL。下列仪器中,完成本实验一定不需要选择的是(填字母)。
(2)
为测定 的焓变,甲同学设计了如下实验方案i.
的焓变,甲同学设计了如下实验方案i.
(3)
实验Ⅱ中,V=,加水的目的是。
(4)
设计实验Ⅰ、Ⅱ的目的是。
(5)
实验结果:t1>t3 , 由此可推出的实验结论是。

方案 | 操作 |
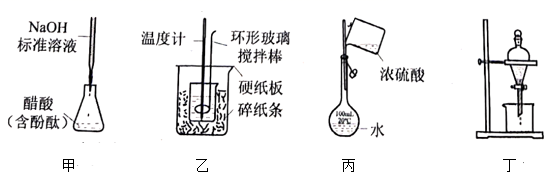
i | 在如图所示的简易量热器中加入2.8g铁粉,再加入100mL(1)中配制好的 0.1mol·L-¹Fe2(SO4)3溶液,测定放出热量Q1kJ;计算反应热为ΔH1
|
①本实验中“搅拌”的操作方法是;(填“能”或“不能”)用金属搅拌器(搅拌器不参与反应)替代玻璃搅拌器。
②乙同学认为甲同学设计的实验方案测得的结果误差较大,判断依据是。基于相关原理,乙同学重新设计了优化的实验方案ii;
方案 | 操作 |
ii | 第1步,在如图所示的简易量热器中加入2.8g铁粉,再加入100mL0.1mol·L-¹CuSO4溶液,测定放出热量Q2kJ,计算反应热为ΔH2; 第2步,在如图所示的简易量热器中加入3.2g铜粉,再加入100mL(1)中配制好的0.1mol·L-¹Fe2(SO4)3溶液,测定放出热量Q3kJ,计算反应热为ΔH3. |
根据方案ii测定结果计算:。(用含△H2、ΔH3的代数式表示)
实验(二)探究影响Cu和反应速率的外界因素。
实验 | 纯铜粉质量/g | 0.1mol·L-¹Fe2(SO4)3(aq)体积/mL | 水 体积/mL | 水浴 温度/℃ | 测定铜粉完全溶解所用时间/min |
I | 0.3 | 60 | 0 | 35℃ | t1 |
Ⅱ | 0.3 | 50 | V | 35℃ | t2 |
Ⅲ | 0.3 | 60 | 0 | 45℃ | t3 |
【考点】
中和热的测定;
能力提升
真题演练