1.
某实验小组用 溶液与
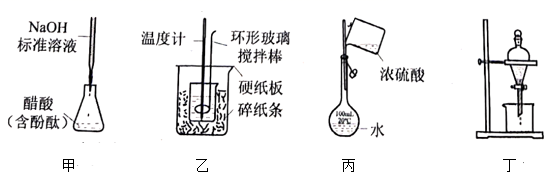
溶液与 硫酸溶液进行中和热的测定,装置如图所示。回答下列问题:
硫酸溶液进行中和热的测定,装置如图所示。回答下列问题:

(1)
若实验共需要400mLNaOH溶液,实验室在配制该溶液时则需要称量NaOH固体g。在配制该溶液时必需用到的玻璃仪器有玻璃棒,烧杯和。
(2)
图中碎泡沫塑料的作用是。
(3)
用同一温度计测量完硫酸溶液,再去测量氢氧化钠溶液的温度之前,所需的操作是。
(4)
请填写表中的平均温度差:
(5)
近似认为 溶液与
溶液与 硫酸溶液的密度都是
硫酸溶液的密度都是 , 中和后生成溶液的比热容
, 中和后生成溶液的比热容 , 则上述实验测得的中和热
, 则上述实验测得的中和热 (结果保留至小数点后一位)。
(6)
上述实验测得中和热的数值小于
(结果保留至小数点后一位)。
(6)
上述实验测得中和热的数值小于 , 产生偏差的原因可能是___________。
A.
量取NaOH溶液时俯视读数
B.
配制NaOH溶液定容时俯视
C.
实验装置保温隔热效果差
D.
向酸溶液中一次性加入碱溶液
, 产生偏差的原因可能是___________。
A.
量取NaOH溶液时俯视读数
B.
配制NaOH溶液定容时俯视
C.
实验装置保温隔热效果差
D.
向酸溶液中一次性加入碱溶液
实验序号 | 起始温度 | ||||
NaOH | 平均值 | ||||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
【考点】
中和热的测定;
能力提升
真题演练