1.
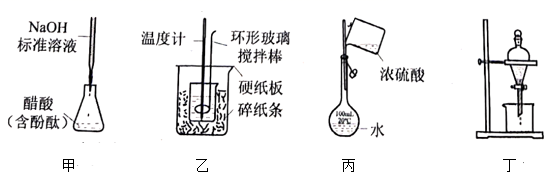
利用如图简易量热计测定中和反应反应热。

①在量热计内筒中加入溶液,插入温度计,记录初始温度为20.0℃;
②向250mL的烧杯中加入溶液,调节其温度,使之也为20.0℃;
③快速将烧杯中的碱液倒入量热计内筒中,盖好杯盖,匀速搅拌,记录体系达到的最高温度为23.3℃。
回答下列问题:
(1)
上述反应过程中释放的能量为kJ[已知:稀溶液的密度均为 , 水的比热容为
, 水的比热容为 ]。
(2)
写出表示该反应反应热的离子方程式:。
(3)
精确实验测得中和反应生成
]。
(2)
写出表示该反应反应热的离子方程式:。
(3)
精确实验测得中和反应生成 的反应热
的反应热 , 本实验出现误差的原因可能是___________(填字母)。
A.
NaOH溶液久置变质
B.
温度计读数不是最高温度
C.
NaOH溶液一次性倒入量热计中
D.
量热计隔热效果差
(4)
在实验中,如果用
, 本实验出现误差的原因可能是___________(填字母)。
A.
NaOH溶液久置变质
B.
温度计读数不是最高温度
C.
NaOH溶液一次性倒入量热计中
D.
量热计隔热效果差
(4)
在实验中,如果用 的KOH溶液代替NaOH溶液,混合后最高温度与用NaOH溶液时的最高温度(填“相同”或“不同”),说明理由:。
的KOH溶液代替NaOH溶液,混合后最高温度与用NaOH溶液时的最高温度(填“相同”或“不同”),说明理由:。
【考点】
中和热的测定;
能力提升
真题演练