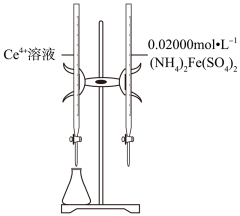
1.
测定铁矿石中铁含量的传统方法是 , 滴定法。研究小组用该方法测定质量为
, 滴定法。研究小组用该方法测定质量为 的某赤铁矿试样中的铁含量。
的某赤铁矿试样中的铁含量。
【配制溶液】
①标准溶液。
②溶液:称取
溶于
浓盐酸,加水至
, 加入少量锡粒。
【测定含量】按下图所示(加热装置路去)操作步骤进行实验。

已知:氯化铁受热易升华;室温时 , 可将
氧化为
。难以氧化
;
可被
还原为
。回答下列问题:
(1)
下列仪器在本实验中必须用到的有(填名称)。
(2)
结合离子方程式解释配制 溶液时加入锡粒的原因:。
(3)
步骤I中“微热”的原因是。
(4)
步骤Ⅲ中,若未“立即滴定”,则会导致测定的铁含量(填“偏大”“偏小”或“不变”)。
(5)
若消耗
溶液时加入锡粒的原因:。
(3)
步骤I中“微热”的原因是。
(4)
步骤Ⅲ中,若未“立即滴定”,则会导致测定的铁含量(填“偏大”“偏小”或“不变”)。
(5)
若消耗 标准溶液
标准溶液 , 则
, 则 试样中
试样中 的质量分数为(用含a、c、V的代数式表示)。
(6)
的质量分数为(用含a、c、V的代数式表示)。
(6)
 滴定法也可测定铁的含量,其主要原理是利用
滴定法也可测定铁的含量,其主要原理是利用 和
和 将铁矿石试样中
将铁矿石试样中 还原为
还原为 , 再用
, 再用 标准溶液滴定。
标准溶液滴定。

①从环保角度分析,该方法相比于 , 滴定法的优点是。
②为探究溶液滴定时,
在不同酸度下对
测定结果的影响,分别向下列溶液中加入1滴
溶液,现象如下表:
溶液 | 现象 | |
空白实验 |
| 紫红色不褪去 |
实验I |
| 紫红色不褪去 |
实验ⅱ |
| 紫红色明显变浅 |
表中试剂X为;根据该实验可得出的结论是。
【考点】
探究物质的组成或测量物质的含量;
能力提升
真题演练