1.
黄铜矿(主要成分为CuFeS2)可用于冶炼Cu2O,主要物质转化过程如下:

(1)
Cu2S与O2共热制备Cu2O的反应中,化合价升高的元素是。
(2)
为减少SO2对环境的污染,在高温时可以用CaO将其转化为CaSO4 , 反应的化学方程式为。
(3)
SO2中心原子的杂化方式是,用价层电子对互斥理论解释SO2的空间结构不同于CO2的原因:。
(4)
下图中,表示Cu2O晶胞的是(填“图1”或“图2”)。
(5)
Cu2O与Cu2S都可视为离子晶体,且结构相似,但Cu2O的熔点比Cu2S的高约100℃,原因是。
(6)
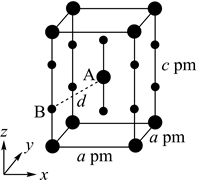
CuFeS2的晶胞如图3所示。


①图4所示结构单元不能作为CuFeS2晶胞的原因是。
②从图3可以看出,每个CuFeS2晶胞中含有的Cu原子个数为。
③已知:CuFeS2晶体的密度是4.30g/cm3 , 阿伏加德罗常数的值为NA。CuFeS2晶胞中底边边长a=pm(用计算式表示;1cm=1010pm;CuFeS2的摩尔质量为184g/mol)。
【考点】
判断简单分子或离子的构型;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
能力提升
真题演练