1.
硼、钾和硒( )在化工行业中有重要用途,请回答下列问题。
)在化工行业中有重要用途,请回答下列问题。
(1)
X是一种抗癌新药,其结构如下:
(2)
氨硼烷( )具有良好的储氢能力,分子中有配位键。则氨硼烷中
)具有良好的储氢能力,分子中有配位键。则氨硼烷中 的键角(填“>”“<”或“=”)
的键角(填“>”“<”或“=”) 的键角,理由是。
(3)
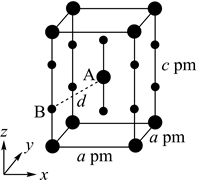
某化合物晶体晶胞结构如图所示,该立方晶胞边长为
的键角,理由是。
(3)
某化合物晶体晶胞结构如图所示,该立方晶胞边长为 。该晶体中与
。该晶体中与 最近且距离相等的
最近且距离相等的 有个,晶体的密度为
有个,晶体的密度为 (列出计算式,用
(列出计算式,用 表示阿伏加德罗常数)。
表示阿伏加德罗常数)。

①硒元素的基态原子核外电子排布式为。
②关于化合物X,下列说法正确的是。
A.碳、硒元素的杂化方式均为
B.元素电负性大小
C.能量最低的激发态原子的电子排布式:
D.该新药中有8种不同化学环境的碳

【考点】
判断简单分子或离子的构型;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;
能力提升
真题演练