1.
非金属氟化物在生产、生活和科研中应用广泛。回答下列问题:
(1)
基态F原子核外电子的运动状态有 种。
(2)
O、F、Cl电负性由大到小的顺序为;OF2分子的空间构型为;OF2的熔、沸点 (填“高于”或“低于”)Cl2O,原因是。
(3)
Xe是第五周期的稀有气体元素,与F形成的XeF2室温下易升华。XeF2中心原子的价层电子对数为,下列对XeF2中心原子杂化方式推断合理的是(填标号)。
(4)
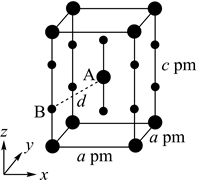
XeF2晶体属四方晶系,晶胞参数如图所示,晶胞棱边夹角均为90°,该晶胞中有个XeF2分子。以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称为原子的分数坐标,如A点原子的分数坐标为(  ,
,  ,
,  )。已知Xe—F键长为rpm,则B点原子的分数坐标为;晶胞中A、B间距离d=pm。
)。已知Xe—F键长为rpm,则B点原子的分数坐标为;晶胞中A、B间距离d=pm。
A.sp B.sp2 C.sp3 D.sp3d
【考点】
原子核外电子的运动状态;
原子核外电子的能级分布;
判断简单分子或离子的构型;
晶胞的计算;
原子轨道杂化方式及杂化类型判断;