1.
实验室以工业废渣(主要含 , 还含少量
, 还含少量 、
、 、FeO、
、FeO、 )为原料制取
)为原料制取 晶体和轻质
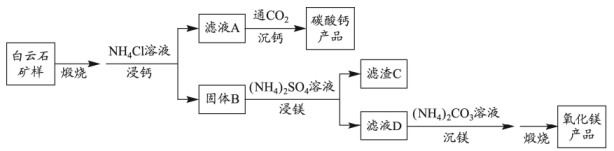
晶体和轻质 , 其实验流程如下:
, 其实验流程如下:
已知:①金属离子形成氢氧化物沉淀的pH范围
金属离子 | ||||
开始沉淀时pH | 3.4 | 2.7 | 7.6 | 11.3 |
完全沉淀时pH | 4.7 | 3.7 | 9.6 | / |
②已知常温下, ,
,
过量的强碱可将转化为
:
,
回答下列问题:
(1)
请写出一条“浸取”时加快速率的措施。
(2)
“浸取”时, 转化为
转化为 , 离子方程式为。
(3)
废渣粉末“浸取”时,反应温度需控制在60~70℃,若温度过高将会使
, 离子方程式为。
(3)
废渣粉末“浸取”时,反应温度需控制在60~70℃,若温度过高将会使 分解而导致
分解而导致 的转化率下降,合适的加热方式为。
(4)
“滤渣1”成分是(填化学式),加适量
的转化率下降,合适的加热方式为。
(4)
“滤渣1”成分是(填化学式),加适量 的作用是(用离子方程式表示)。
(5)
“调pH”除铁和铝时,应调节溶液的pH≥;同时,要控制溶液中的pH不能过高,否则会导致
的作用是(用离子方程式表示)。
(5)
“调pH”除铁和铝时,应调节溶液的pH≥;同时,要控制溶液中的pH不能过高,否则会导致 转化为
转化为 。当
。当 大于mol/L时,
大于mol/L时, 开始转化为
开始转化为 (此时可认为
(此时可认为 离子浓度为
离子浓度为 )。
)。
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;
能力提升
真题演练