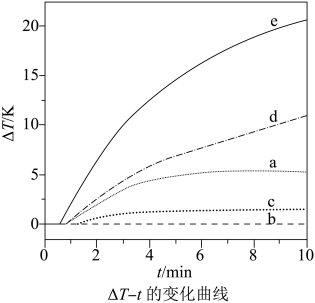
1.
毒重石的主要成分为BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2•2H2O的流程如图所示:

已知:①
离子 | Ca2+ | Mg2+ | Fe3+ |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
②Ksp(BaC2O4) = 1.6×10-7 Ksp(CaC2O4) = 2.3×10-9
(1)
毒重石用盐酸浸取前需充分研磨,目的是。
(2)
加入氨水调节pH=8可除去(填离子符号),滤渣II中含有(填化学式)。
(3)
滤渣I在水中的的沉淀溶解平衡可表示为。
(4)
通常认为残留在溶液中的离子浓度小于1.0×10-5 mol∙L-1时即为除杂完全,则Ca2+沉淀完全时溶液中[C2O ]至少是,但加入H2C2O4溶液时应避免过量,原因是。
]至少是,但加入H2C2O4溶液时应避免过量,原因是。
【考点】
难溶电解质的溶解平衡及沉淀转化的本质;
能力提升
真题演练