1.
阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO425.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)
该学生用标准0.14mol·L-1NaOH溶液滴定硫酸的实验操作如下:
(2)
碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)。
(3)
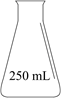
配制准确浓度的稀H2SO4溶液,必须使用的主要容器是:。
(4)
如有1mol/L和0.1mol/L的NaOH溶液,应用的NaOH溶液,原因是。
(5)
用标准NaOH溶液滴定时,应将标准NaOH溶液注入(选填“甲”或“乙”)中。(如图所示)
(6)
观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值。(选填“偏大”“偏小”或“无影响”)
(7)
计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位)。
A.用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入2滴酚酞
B.用待测定的溶液润洗酸式滴定管
C.用蒸馏水洗干净滴定管
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E.检查滴定管是否漏水
F.另取锥形瓶,再重复操作一次
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)。
E→C→D→___________→___________→___________→F
②在G操作中如何确定终点?。

【考点】
中和滴定;
能力提升
真题演练

 b.
b. c.
c.