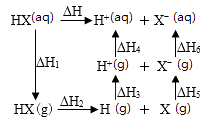1.
请应用化学反应原理的相关知识解决下列问题:
(1)已知NaCl的溶解过程:NaCl(s)=Na+(aq)+Cl-(aq) ΔH=+3.8kJ/mol
Na(s)-e-=Na+(aq) ΔH=-240kJ/mol,
Cl2(g)+e-=Cl-(aq) ΔH=-167kJ/mol,写出钠在氯气中燃烧的热化学方程式。
(2)一定条件下,在2L恒容密闭容器中充入1.5molCO2和3molH2发生反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g),图是反应体系中CO2的平衡转化率与温度的关系曲线。已知在温度为500K的条件下,该反应10min达到平衡;
①该反应是(填“吸热”或“放热”)反应。
②在0~10min时段反应速率v(H2)为。
③若改充入2molCO2和3molH2 , 图中的曲线会(填“上移”或“下移”)。
(3)根据表数据回答问题:
表1 25℃时浓度为0.1mol/L两种溶液的pH
溶质 | NaClO | Na2CO3 |
pH | 9.7 | 11.6 |
表2 25℃时两种酸的电离平衡常数
Ka1 | Ka2 | |
H2SO3 | 1.3×10-2 | 6.3×10-8 |
H2CO3 | 4.2×10-7 | 5.6×10-11 |

①根据表1能不能判断出H2CO3与HClO酸性强弱?(填“能”或“不能”)。
②0.10mol·L-1Na2SO3溶液中离子浓度由大到小的顺序为。
③H2SO3溶液和NaHCO3溶液反应的离子方程式为。
(4)已知:t℃时,Ksp(AgCl)=1.5×10-10、Ksp(Ag2CrO4)=2.0×10-12;AgCl为白色沉淀,Ag2CrO4为砖红色沉淀,t℃时,向Cl-和浓度均为0.1mol/L的混合溶液中逐滴加入AgNO3溶液至过量且不断搅拌,实验现象为。
【考点】
盖斯定律及其应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练