1.
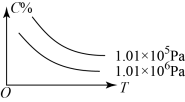
对于可逆反应A(g)+2B(g) 2C(g) (正反应吸热),下列图像正确的是
2C(g) (正反应吸热),下列图像正确的是
A.
 B.
B.
 C.
C.
 D.
D.

 B.
B.
 C.
C.
 D.
D.

【考点】
化学平衡移动原理;
化学平衡转化过程中的变化曲线;