1.
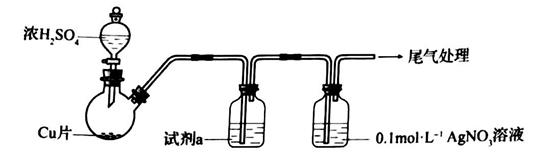
某实验小组采用下图装置模拟硫酸工业中 的催化氧化,并测定:
的催化氧化,并测定: 的转化率。
的转化率。
已知:的熔点是72.7℃,沸点是-10℃。

(1)
仪器a的名称为。
(2)
反应开始时,打开 , 关闭
, 关闭 , 使
, 使 和
和 一起通过装置C进入D中发生反应,反应后的气体进入装置E,装置E的作用为。
(3)
装置B中NaOH的作用是;该试剂可替换为(填字母)。
(4)
装置F中现象说明气体吸收完全。
(5)
反应结束后测得装置E质量增加10.0g,装置F质量增加4.8g,则该条件下:
一起通过装置C进入D中发生反应,反应后的气体进入装置E,装置E的作用为。
(3)
装置B中NaOH的作用是;该试剂可替换为(填字母)。
(4)
装置F中现象说明气体吸收完全。
(5)
反应结束后测得装置E质量增加10.0g,装置F质量增加4.8g,则该条件下: 的转化率为。(保留三位有效数字,反应物转化率
的转化率为。(保留三位有效数字,反应物转化率 )
)

A.饱和溶液 B.饱和
溶液
C.溶液 D.
溶液
【考点】
二氧化硫的性质;
含硫物质的性质及综合应用;
能力提升
真题演练