1.
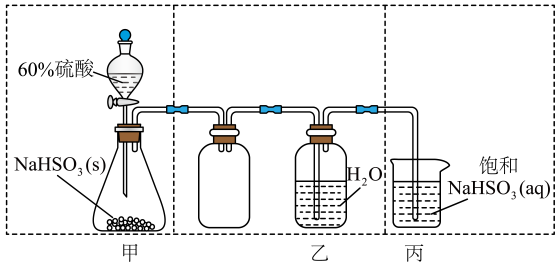
某研究小组为探究SO2和Fe(NO3)3溶液反应的实验。设计了如图所示装置进行实验:

请回答:
(1)
装置A中仪器a名称为。
(2)
下列能作为SO2尾气处理试剂的有。
(3)
装置B中产生了白色沉淀,其成分是。推测B中产生白色沉淀的原因。
(4)
若将装置B中的1.0mol/L的Fe(NO3)3替换成浓氨水,写出B中发生的离子反应方程式。
A.酸性KMnO4溶液 B.浓NaOH溶液 C.品红溶液 D.CaCl2溶液 E.浓HNO3
观点1:SO2与Fe3+反应;
观点2:在酸性条件下SO2与反应;
观点3:装置内的氧气将SO2氧化
①若观点1正确,除产生白色沉淀外,还应观察到的现象是。
②若观点2正确,装置B中反应的离子方程式是。
③若要排除观点3的干扰,实验前需要进行的实验操作是。
【考点】
二氧化硫的性质;
能力提升
真题演练