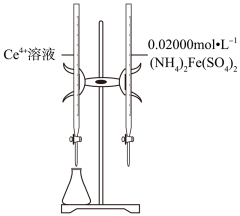
1.
早在1785年,卡文迪许在测定空气组成时,除去空气中的 、
、 等已知气体后,发现最后总是留下一个体积不足总体积1/200的小气泡;
等已知气体后,发现最后总是留下一个体积不足总体积1/200的小气泡;
1892年,瑞利在测定氮气密度时发现,从空气中得到的氮气密度为 , 而从氨分解得到的氮气密度为
;两者相差
。
有人认为:以上两种氮气很小的密度差别可能来源于实验误差,瑞利在多次试验中发现,从空气中得到的氮气密度总是比从氨分解得到的氮气密度略大。
瑞利和拉姆赛共同研究后认为:以上两个实验中的“小误差”可能有某种必然的联系,并预测大气中含有某种较重的未知气体.经反复实验,他们终于发现了一种化学性质极不活泼的新气体,比氮气(已知氮气能与某些活泼金属在加热时发生剧烈反应)都要稳定许多。
(1)
在瑞利和拉姆赛预测中的那种未知的气体密度与氮气密度比较是(选填“大”或“小”或“无法确定”);
(2)
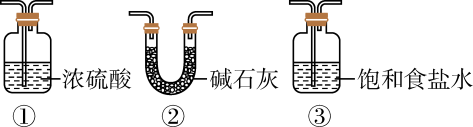
某同学使用以下一些装置来模拟卡文迪许的实验:
A. B.
B. C.
C.
D. E.
E.
请将仪器连接的最佳顺序(按空气流向填各接口的编号)排列于右:→→a。其中D装置的作用是;写出在C装置中发生化学反应的方程式。
【考点】
探究物质的组成或测量物质的含量;
能力提升
真题演练