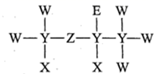1.
黑火药是中华民族对人类文明的重大贡献。“它”由硝酸钾(KNO3)、硫磺(S)、木炭(C)按一定比例混合而成,上述非金属元素中,原子半径最大的是,非金属性最强。(填元素符号)从原子结构角度解释O元素的非金属性强于N元素的原因。
【考点】
元素周期表中原子结构与元素性质的递变规律;
微粒半径大小的比较;