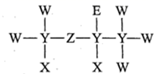1.
硼酸( )为一元弱酸,广泛用于玻璃、医药等工业。已知:
)为一元弱酸,广泛用于玻璃、医药等工业。已知: , 则
, 则 的电离方程式为。酸性:
的电离方程式为。酸性:
 (填“>”或“<”)。
(填“>”或“<”)。
【考点】
元素周期表中原子结构与元素性质的递变规律;
基础巩固
能力提升
变式训练
拓展培优
真题演练