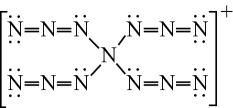1.
价层电子对互斥模型认为,分子的空间结构是中心原子周围的“价层电子对”相互排斥的结果。VSEPR的“价层电子对”是指分子中的中心原子与结合原子间的 键电子对和中心原子上的孤电子对。多重键只计其中的
键电子对和中心原子上的孤电子对。多重键只计其中的 键电子对,不计
键电子对,不计 键电子对。学习了价层电子对互斥模型和杂化轨道理论以后,可以先确定分子或离子的VSEPR模型、然后就可以比较方便地确定中心原子的杂化轨道类型。
键电子对。学习了价层电子对互斥模型和杂化轨道理论以后,可以先确定分子或离子的VSEPR模型、然后就可以比较方便地确定中心原子的杂化轨道类型。
分子中氮原子的孤电子对数,杂化轨道类型为,分子空间构型为。
【考点】
判断简单分子或离子的构型;
原子轨道杂化方式及杂化类型判断;
基础巩固
能力提升
变式训练
拓展培优
真题演练

 )两种存在形式,两种形式中S原子的杂化轨道类型相同
)两种存在形式,两种形式中S原子的杂化轨道类型相同