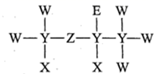1.
某研究性学习小组为探究元素周期表中元素性质的递变规律,设计了下列实验:
Ⅰ.探究同周期元素金属性的递变规律(已知:强碱可以制弱碱)。
(1)小组同学利用铝、镁的可溶性盐进行如图1实验,实验中可观察到的现象是;可得出金属性:Mg>Al,得出该结论的实验依据是,实验2发生反应的离子方程式为。

Ⅱ.利用图2装置验证同主族元素非金属性的变化规律(已知:强酸可以制弱酸)。

(2)已知H2SiO3是白色沉淀。若要证明非金属性:C>Si,则在甲装置A中加稀硫酸、B中加Na2CO3固体,试管C中加Na2SiO3溶液,B中反应的离子方程式为,试管C中产生白色沉淀,可证明酸性:H2CO3>H2SiO3 , 即非金属性:CSi(填“>”或“<”);将甲装置换成乙装置,(填“能”或“不能”)证明非金属性:Cl>C>Si,其原因是。
【考点】
元素周期表中原子结构与元素性质的递变规律;