1.
 的回收与利用是科学家研究的热点课题,可利用
的回收与利用是科学家研究的热点课题,可利用 与
与 制备“合成气(CO、
制备“合成气(CO、 ),还可制备甲醇、二甲醚、碳基燃料等产品。
),还可制备甲醇、二甲醚、碳基燃料等产品。
(1)
甲烷二氧化碳干式重整涉及以下反应:
(2)
“合成气”在催化剂作用下反应,可以直接合成甲醇:
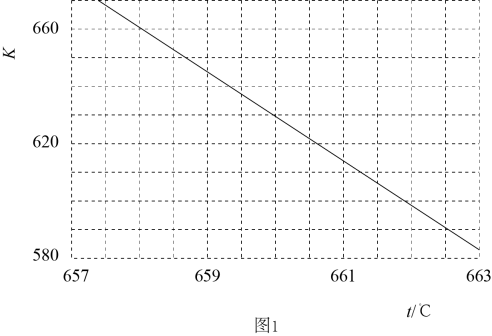
 , 测得相同时间内甲醇产率与温度的关系如图1所示。
(3)
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为:
, 测得相同时间内甲醇产率与温度的关系如图1所示。
(3)
利用“合成气”合成甲醇后,甲醇脱水制得二甲醚的反应为: , 当
, 当 时,反应平衡常数
时,反应平衡常数 , 在密闭答器中加入一定量
, 在密闭答器中加入一定量 , 反应到达平衡状态时,体系中
, 反应到达平衡状态时,体系中 的物质的量分数(填标号)。
(4)
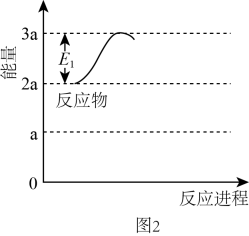
我国科技工作者发明了一种电化学分解甲烷制备
的物质的量分数(填标号)。
(4)
我国科技工作者发明了一种电化学分解甲烷制备 的方法,其电化学反应原理如图2所示。请写出Ni-YSZ电极上发生的电极反应方程式:,标况下每分解
的方法,其电化学反应原理如图2所示。请写出Ni-YSZ电极上发生的电极反应方程式:,标况下每分解 , Ni电极产生的
, Ni电极产生的 的物质的量是。
的物质的量是。

i.
ii.
iii.
①为标准摩尔生成焓,其定义为标准状态下,由稳定相态的单质生成1mol该物质的焓变。对于稳定相态单质,
其为零。根据下表所示数据,计算反应
的反应热
物质 | CO | ||
②在体积为的恒温恒容密闭容器中,通入
、
和
发生甲烷二氧化碳干式重整反应,达到平衡时,
,
, 反应ⅲ的平衡常数
(用含有a和b的代数式表示)。

温度在800℃以上甲醇产率下降的原因是。
a. b.
c.
d.无法确定

【考点】
化学反应速率与化学平衡的综合应用;
能力提升
真题演练