1.
CS2是一种重要的化工原料。工业上可以利用硫(S8)与CH4为原料制备CS2 , S8受热分解成气态S2 , 发生反应  ,回答下列问题:
,回答下列问题:
(1)
CH4的电子式为,CS2分子的立体构型为。
(2)
某温度下,若S8完全分解成气态S2。在恒温密闭容器中,S2与CH4物质的量比为2∶1时开始反应。
(3)
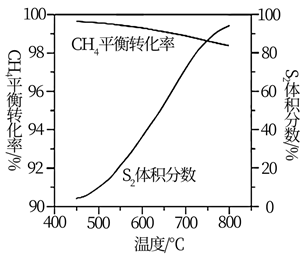
一定条件下,CH4与S2反应中CH4的平衡转化率、S8分解产生S2的体积分数随温度的变化曲线如图所示。据图分析,生成CS2的反应为(填“放热”或“吸热”)反应。工业上通常采用在600~650℃的条件下进行此反应,不采用低于600℃的原因是。
(4)
用燃煤废气(含N2、O2、SO2、CO2、H2O、NOx等)使尾气中的H2S转化为单后硫S,可实现废物利用,保护环境,写出其中一个反应的化学方程式。
①当CS2的体积分数为10%时,CH4的转化率为。
②当以下数值不变时,能说明该反应达到平衡的是(填序号)。
a.气体密度b.气体总压c.CH4与S2体积比d.CS2的体积分数
【考点】
化学反应速率与化学平衡的综合应用;
电子式、化学式或化学符号及名称的综合;
能力提升






