1.
研究氮氧化物转化的机理对环境保护具有重要意义。请回答下列问题:
(1)
 是硝酸生产中氨催化氧化的副产物,
是硝酸生产中氨催化氧化的副产物, 还原处理
还原处理 的原理为
的原理为 。
(2)
处理汽车尾气的原理为
。
(2)
处理汽车尾气的原理为 。将体积比为1∶1的
。将体积比为1∶1的 和
和 混合气体以相同流速通过两种不同的催化剂I、Ⅱ,发生上述反应(不考虑其他反应),相同时间内尾气脱氮率(即
混合气体以相同流速通过两种不同的催化剂I、Ⅱ,发生上述反应(不考虑其他反应),相同时间内尾气脱氮率(即 转化率)与温度的关系如图所示。
转化率)与温度的关系如图所示。
①写出硝酸生产中氨发生催化氧化的化学方程式:。
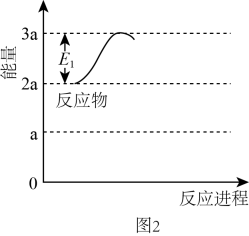
②在作用下,反应
的能量变化如图所示:

则的
。

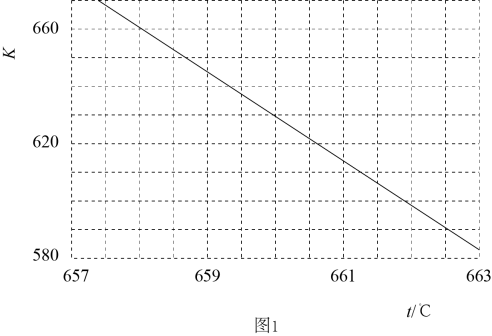
①M点脱氮率大于N点的原因可能是。
②下列能说明该反应处于化学平衡状态的是(填字母)。
A.的质量分数保持不变
B.容器中与
的百分含量之比保持不变
C.
D.容器中混合气体的平均相对分子质量保持不变
③若Q点反应已达平衡,体系总压强为 , 则该温度下
(
为用分压代替浓度计算的平衡常数,分压=总压×物质的量分数,用含a的代数式表示)。
【考点】
化学反应速率与化学平衡的综合应用;
能力提升
真题演练