1.
 的回收和利用是实现“碳中和”的有效途径。在一恒容密闭反应器中充入体积之比为
的回收和利用是实现“碳中和”的有效途径。在一恒容密闭反应器中充入体积之比为 的
的 和
和 , 发生反应:①
, 发生反应:①
 , ②
, ②
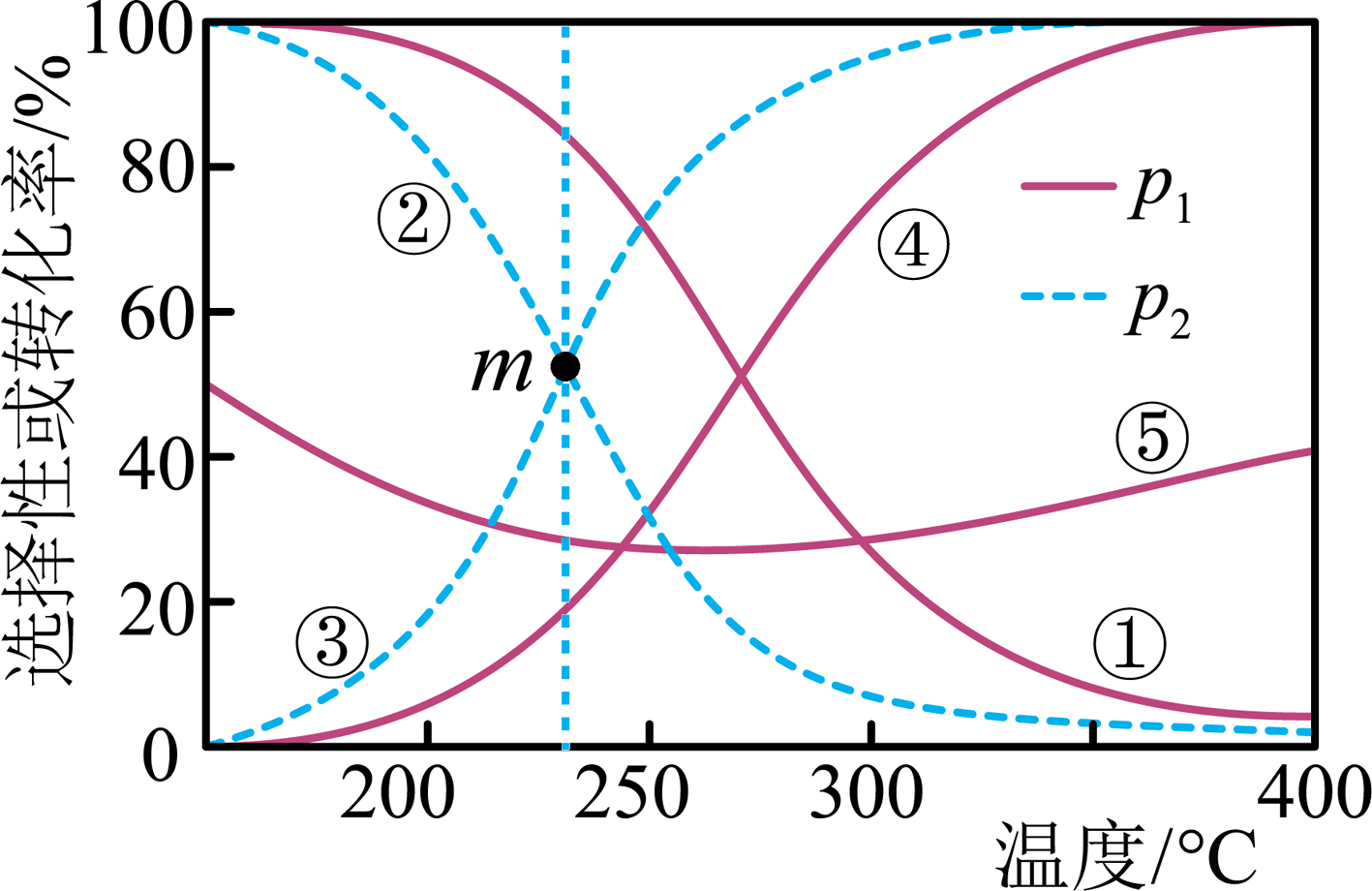
 。在相同时间内,
。在相同时间内, 的转化率、
的转化率、 的选择性[
的选择性[ 的选择性
的选择性 ]与温度的关系如图所示。下列叙述错误的是( )
]与温度的关系如图所示。下列叙述错误的是( )

A.
温度高于 时,主要发生反应②
B.
温度低于
时,主要发生反应②
B.
温度低于 时,
时, 的选择性随温度升高而增大
C.
平衡时,再充入
的选择性随温度升高而增大
C.
平衡时,再充入 和
和 , 再次达到平衡时,
, 再次达到平衡时, 的物质的量增大
D.
的物质的量增大
D.
 下反应达到平衡时,
下反应达到平衡时, 、
、 、
、 的浓度之比为
的浓度之比为
【考点】
化学平衡移动原理;
化学平衡转化过程中的变化曲线;
化学反应速率与化学平衡的综合应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练

 )是重要的化工原料,可由异丁醇(
)是重要的化工原料,可由异丁醇( )脱水制得。异丁醇催化脱水时发生如下反应:
)脱水制得。异丁醇催化脱水时发生如下反应: