1.
化学探究不仅激发同学们学习化学的兴趣也能提高学习能力,有助于开发同学们的智慧潜力。某化学兴趣小组在老师的指导下,对水蒸气通过灼热的焦炭后得到的混合气体进行了实验探究。
【提出问题】水蒸气通过灼热的焦炭后得到的混合气体含有哪些成分?
【猜想与假设】
猜想一:只含有一氧化碳、氢气。
猜想二:含有一氧化碳、二氧化碳、氢气和水蒸气。
猜想三:只含有二氧化碳、氢气和水蒸气。
猜想四:只含有一氧化碳、二氧化碳和氢气。
【查阅资料】
①无水硫酸铜遇水由白色变为蓝色。
②碱石灰是固体氢氧化钠和氧化钙的混合物。
③氢气与一氧化碳都具有还原性。
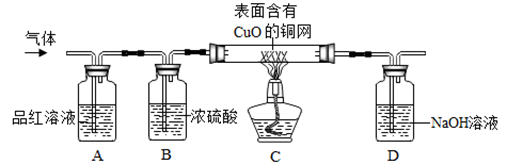
【收集证据】同学们在老师的指导下设计了如图1所示装置(部分夹持仪器已略去),并进行了实验。

图1
(1)
装置A中无水硫酸铜由白色变为蓝色,装置B中澄清石灰水变浑浊,由此得出的结论为混合气体中有。
(2)
反应前装置C中的药品为溶液,其目的为。
(3)
反应后E中红色粉末变为黑色,F中无水硫酸铜由白色变为蓝色,G中澄清石灰水变浑浊,说明混合气体中还存在的气体是。E中发生反应的化学方程式为。
(4)
装置H的作用是。
(5)
【实验结论】猜想正确。
(6)
【实验反思】经过讨论,同学们将如图1装置进行了简化。只用如图2所示装置并自选必要试剂就能完成探究(假设每步都完全反应)。实验过程中干燥的凉烧杯内壁能观察到的现象是,应补充的最后一步实验操作及现象是。

图2
【考点】
常见气体的检验;
实验探究物质的组成成分以及含量;
能力提升
真题演练