1.
某学习小组对铜丝在空气中灼烧后的产物进行探究。
实验1甲同学将螺旋状铜丝灼烧至红热,冷却后观察到铜丝表面变为黑色,再伸入质量分数为25%的稀硫酸中,黑色固体消失,溶液出现蓝色,将铜丝取出洗净;重复上述实验2~3次,溶液蓝色逐渐加深。
(1)
【实验分析】灼烧铜丝生成黑色固体,该反应属于基本反应类型中的反应。溶液变为蓝色的原因是(用化学方程式表示)。
(2)
【提出问题1】红色固体是什么?
(3)
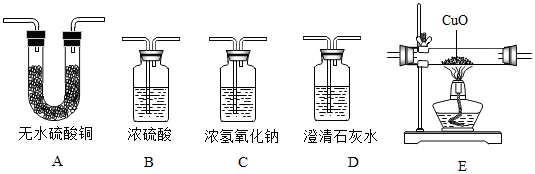
装置B中浓硫酸的作用是。
(4)
实验时,应先将产生的氢气通入装置C中,待,再开始加热。
(5)
实验中观察到(填实验现象),说明红色固体中含有Cu2O,丙同学猜想不正确。
(6)
【提出问题2】实验2中有稀硫酸存在的情况下,为什么红色固体中仍含有Cu2O?
实验2乙同学将螺旋状铜丝灼烧至红热,迅速伸入质量分数为25%的稀硫酸中,观察到溶液中有红色固体产生,将铜丝取出洗净;重复上述实验2~3次,红色固体逐渐增多,沉淀后滤出红色固体,滤液呈浅蓝色。
【查阅资料1】①Cu与O2在高于900℃时会反应生成红色的Cu2O。
②Cu2O能与H2SO4发生反应:。
③加热条件下,Cu2O能与H2反应生成Cu和H2O。
【提出猜想】丙同学认为红色固体全部是Cu,不含Cu2O。
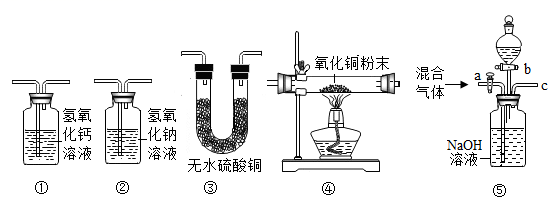
【实验验证1】学习小组取经过干燥的红色固体,采用如图装置验证猜想。

仪器X的名称为。
【查阅资料2】Cu2O与H2SO4反应的快慢与稀硫酸的浓度有关。稀硫酸的浓度越大,Cu2O与H2SO4反应越快。
【实验验证2】请设计实验验证“稀硫酸的浓度越大,Cu2O与H2SO4反应越快”这一结论。简述实验过程(包括操作和现象):。
(实验中须使用的试剂:Cu2O、质量分数为5%和40%的稀硫酸)
【问题解决】因实验2中稀硫酸浓度变小,Cu2O与H2SO4反应变慢,Cu2O没有完全反应,故红色固体中仍含有Cu2O。
【考点】
常见气体的检验;
酸的化学性质;
实验探究物质的组成成分以及含量;
反应类型的判定;
能力提升