1.
“一”表示物质可以发生反应,“→”表示物质可以转化,下列说法正确的是

A.
①处发生的是置换反应,常用于实验室制取氢气
B.
②处发生的反应只能是放热反应
C.
③处发生的反应体现了CO的氧化性
D.
为了延长食品保质期,常在食品包装袋中放一包铁粉作吸收剂,利用的原理就是反应④
【考点】
金属的化学性质;
一氧化碳还原氧化铁;
基础巩固
能力提升
变式训练
拓展培优
真题演练











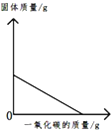 实验室用一氧化碳还原氧化铁
实验室用一氧化碳还原氧化铁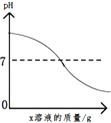 往氢氧化钙溶液中逐滴加入蒸馏水
往氢氧化钙溶液中逐滴加入蒸馏水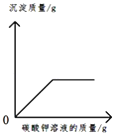 向盐酸和氯化钙的混合溶液中逐滴加入碳酸钾溶液
向盐酸和氯化钙的混合溶液中逐滴加入碳酸钾溶液 将足量粉末状金属分别与等质量、等质量分数的稀盐酸反应
将足量粉末状金属分别与等质量、等质量分数的稀盐酸反应