1.
含铂、铑等活性成分的催化剂能促使汽车尾气中的NO、CO快速转化为无毒气体,发生如下反应: 。
。
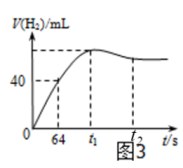
(1)
为了测定在催化剂作用下的反应速率,在某温度下,用二氧化碳传感器测得不同时间的 浓度如表:
浓度如表:
(2)
为了分别验证不同条件对化学反应速率的影响,某同学设计了三组实验,部分实验条件已经填在下面实验设计表格中。
时间/s | 0 | 30 | 60 | 90 | 120 | 150 |
0 |
前2min内的平均反应速率。0~30s和30~60s时间段内反应速率变化的主要原因是。
实验编号 | T/℃ | 催化剂类型 | ||
I | 320 | 铂铑 | ||
II | 稀土 | |||
III | 260 | 铂铑 |
①实验I、III的目的是,故。
②对比实验II、III,改变的条件是,故,
。
【考点】
化学反应速率;
化学反应速率的影响因素;
能力提升
真题演练