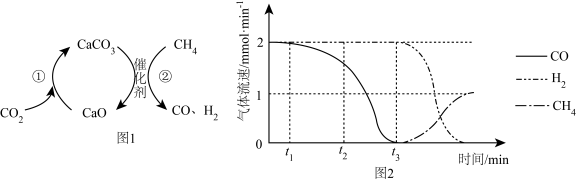
1.
图1实验装置用于测定锌与稀硫酸反应的速率。

(1)
检查图1装置气密性的操作方法是。
(2)
分别取2 g颗粒大小相同的锌粒分别与体积均为40 mL的1 mol·L-1硫酸、4 mol·L-1硫酸反应,收集25 mL H2时所需时间后者比前者。 填“长”或“短”
填“长”或“短” (3)
某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
(4)
实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是,反应进行一定时间后速率逐渐减慢,原因是。
(5)
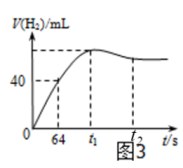
测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是;在64 s内用H+浓度表示的平均反应速率v(H+) = (此时,溶液体积仍为40 mL,气体摩尔体积为25 L·mol-1)。
(3)
某化学兴趣小组对教材实验装置进行图2所示改进。检查装置气密性后进行的实验操作有:
(4)
实验观察到锌与稀硫酸反应初期速率逐渐加快,其原因是,反应进行一定时间后速率逐渐减慢,原因是。
(5)
测得产生H2的体积与反应时间的关系曲线如图3所示,t1~t2时间段氢气体积略有减小的原因是;在64 s内用H+浓度表示的平均反应速率v(H+) = (此时,溶液体积仍为40 mL,气体摩尔体积为25 L·mol-1)。

a. 在多孔塑料袋中装入锌粒;
b. 在锥形瓶中加入40 mL的1 mol·L-1硫酸;
c. 塞好橡胶塞,时立即用秒表计时;
d. 注射器内每增加5mL气体时读取一次秒表。
【考点】
化学反应速率;
化学反应速率的影响因素;
能力提升
真题演练