1.
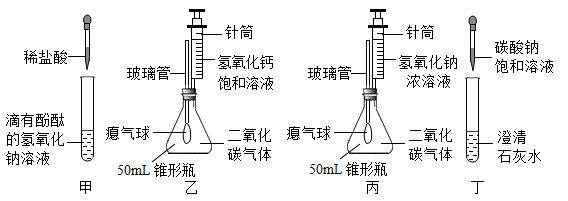
用下图实验证明无明显现象反应的发生。

(1)
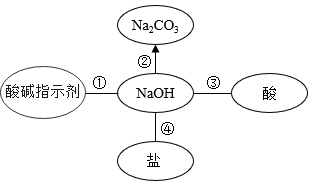
实验1,能证明NaOH与CO2发生反应的现象是,NaOH与CO2反应的化学方程式为。
(2)
实验2,观察到溶液由红色变为无色,从物质性质的角度解释产生上述现象的原因。
【考点】
碱的化学性质;
能力提升
真题演练