1.
一定温度下,向容积为2L的恒容密闭容器中通入一定量N2O4 , 发生反应N2O4(g) 2NO2(g) △H>0,反应起始时容器内气体的总压强为p,体系中各组分的物质的量随时间(t)的变化如表。
2NO2(g) △H>0,反应起始时容器内气体的总压强为p,体系中各组分的物质的量随时间(t)的变化如表。
t/s | 0 | 20 | 40 | 60 | 80 |
n(N2O4)/mol | 0.100 | 0.062 | 0.048 | 0.040 | 0.040 |
n(NO2)/mol | 0 | 0.076 | 0.104 | 0.120 | 0.120 |
下列说法正确的是
A.
20~60s内,NO2的平均反应速率υ=1.1×10−3mol∙L−1∙s−1
B.
N2O4的平衡转化率为40%
C.
该温度下,反应的压强平衡常数Kp= p
D.
80s时,再充入0.03molNO2、0.01molN2O4 , 平衡逆向移动
p
D.
80s时,再充入0.03molNO2、0.01molN2O4 , 平衡逆向移动
【考点】
化学反应速率;
化学平衡的计算;
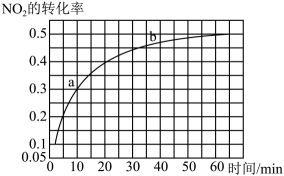







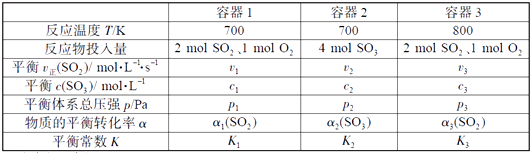
 COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )