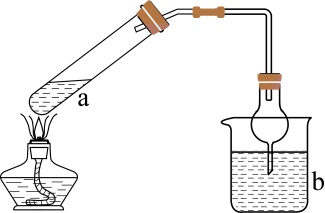
1.
下列实验方法或操作,可以达到实验目的的是
标号 | 实验目的 | 实验方法或操作 |
A | 测定中和反应的反应热 | 酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度 |
B | 探究浓度对化学反应速率的影响 | 量取相同体积、不同浓度的HCl溶液,分别与等质量的大理石发生反应,对比现象 |
C | 探究室温下 | 用pH计测量室温下0.1 mol·L⁻¹氨水的pH |
D | 通过官能团的检验,鉴别乙醇和乙醛 | 取两种待测液体于两支洁净的试管中,加入新制氢氧化铜悬浊液,加热至沸腾,观察现象 |
A.
A
B.
B
C.
C
D.
D
【考点】
化学实验方案的评价;
能力提升
变式训练
拓展培优
真题演练


 C.
C.