1.
常温下,2-戊烯酸(CH3CH2CH=CHCOOH)溶液中含碳粒子分布系数(δ)与溶液pH的关系如图1,向20mL 0. 1 mol· L-12-戊烯酸溶液中滴加0.1 mol·L-1的NaOH溶液,溶液pH与滴入NaOH溶液体积的关系如图2。已知:δ(CH3CH2CH =CHCOOH)= 

下列说法错误的是( )
A.
图1中,曲线I表示的粒子是CH3CH2CH=CHCOO-
B.
图2中,①对应溶液的溶质为2-戊烯酸和2-戊烯酸钠,此时溶液的pH=4. 7,
C.
图2中,②对应的溶液中存在:c(Na+ )=c(CH3CH2CH=CHCOO-)>c(CH3CH2CH=CHCOOH)
D.
图2中,③对应的溶液中存在:c(OH-)=c(H+)+c(CH3CH2CH=CHCOOH)
【考点】
弱电解质在水溶液中的电离平衡;
离子浓度大小的比较;
能力提升
变式训练
拓展培优
真题演练
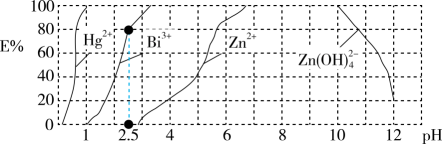


 。
。





