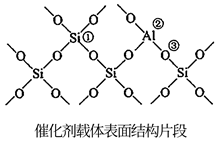
1.
不锈钢具有良好的耐腐蚀性和耐磨性,铬(Cr)是不锈钢的重要成分。完成下列填空:
(1)
I.通过  可以得到较纯的铬,
可以得到较纯的铬,  的熔点比
的熔点比  。(选填“高”或“低”),某工厂用
。(选填“高”或“低”),某工厂用  含
含  的铬铁矿粉
的铬铁矿粉  制备
制备  ,最终得到产品bkg,产率为。(用含a和b的代数式表示)
(2)
II.元素
,最终得到产品bkg,产率为。(用含a和b的代数式表示)
(2)
II.元素  在溶液中主要以(蓝紫色)、
在溶液中主要以(蓝紫色)、  (绿色)、
(绿色)、  (橙红色)、
(橙红色)、  (黄色)等形式存在,
(黄色)等形式存在,  为难溶于水的灰蓝色固体。
(3)
III.
为难溶于水的灰蓝色固体。
(3)
III.  和
和  在溶液中可以相互转化。室温下,初始浓度为
在溶液中可以相互转化。室温下,初始浓度为  溶液中
溶液中  随
随  的变化如图所示。
(4)
写出该反应平衡常数的表达式K=。
(5)
由图可知,溶液酸性增强,
的变化如图所示。
(4)
写出该反应平衡常数的表达式K=。
(5)
由图可知,溶液酸性增强,  的平衡转化率。(选填“增大”、“减小”或“不变”)
(6)
升高温度,溶液中
的平衡转化率。(选填“增大”、“减小”或“不变”)
(6)
升高温度,溶液中  的平衡转化率减小,则该反应是反应。(选填“吸热”或“放热”)
的平衡转化率减小,则该反应是反应。(选填“吸热”或“放热”)
与
的化学性质相似,在
溶液中逐滴加入
溶液直至过量,可观察到的现象是。

用离子方程式表示 溶液中的转化平衡。
【考点】
化学平衡常数;
化学平衡移动原理;
能力提升
真题演练


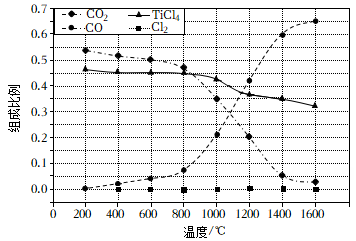
 ①随着温度的升高,Li2CO3的产率逐渐减小的原因是。
①随着温度的升高,Li2CO3的产率逐渐减小的原因是。

 (g) ∆H1<0
(g) ∆H1<0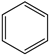 (g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4
(g)+15O2(g)⇌12CO2(g)+6H2O(l) ∆H4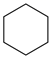 (g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5
(g)+9O2(g)=6CO2(g)+6H2O(l) ∆H5