1.
金属钛( )在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石
)在航空航天、医疗器械等工业领域有着重要用途,目前生产钛的方法之一是将金红石 转化为
转化为 , 再进一步还原得到钛。回答下列问题:
, 再进一步还原得到钛。回答下列问题:
(1)
 转化为
转化为 有直接氯化法和碳氯化法.在
有直接氯化法和碳氯化法.在 时反应的热化学方程式及其平衡常数如下:
(2)
在
时反应的热化学方程式及其平衡常数如下:
(2)
在 , 将
, 将 、C、
、C、 以物质的量比1∶2.2∶2进行反应.体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
(3)
以物质的量比1∶2.2∶2进行反应.体系中气体平衡组成比例(物质的量分数)随温度变化的理论计算结果如图所示。
(3)
 碳氯化是一个“气—固—固”反应,有利于
碳氯化是一个“气—固—固”反应,有利于 “固—固”接触的措施是。
“固—固”接触的措施是。
(ⅰ)直接氯化:
(ⅱ)碳氯化:①反应
的
为
,
。
②碳氯化的反应趋势远大于直接氯化,其原因是。
③对于碳氯化反应:增大压强,平衡移动(填“向左”“向右”或“不”);温度升高,平衡转化率(填“变大”“变小”或“不变”)。
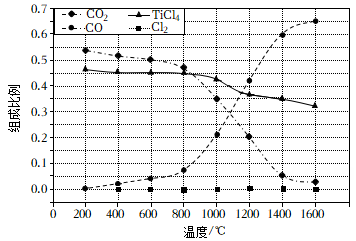
①反应的平衡常数
。
②图中显示,在平衡时
几乎完全转化为
, 但实际生产中反应温度却远高于此温度,其原因是。
【考点】
盖斯定律及其应用;
化学平衡常数;
化学反应速率的影响因素;
化学平衡移动原理;
有关反应热的计算;
能力提升





