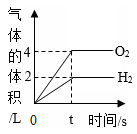
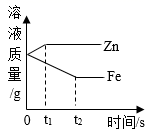
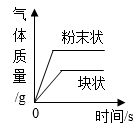
1.
实验研究铁锈蚀影响因素,记录如下、下列分析不正确的是( )
实验装置 | 序号 | 其他试剂 | 100s时O2的含量 |
| ① | 干燥剂 | 21% |
② | 10滴水 | 15% | |
③ | 10滴水和1.0g食盐 | 8% |
A.
②③中O2含量减少表明铁已锈蚀
B.
①②证明水对铁锈蚀有影响
C.
②③证明食盐能加快铁锈蚀
D.
①②③证明炭粉对铁锈蚀有影响
【考点】
影响化学反应速率的因素探究;






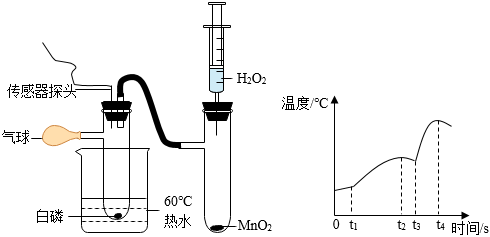
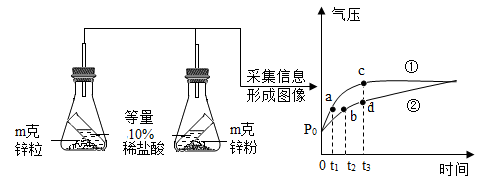








 用方案甲探究同种物质在不同溶剂中的溶解性
用方案甲探究同种物质在不同溶剂中的溶解性 用方案乙探究空气是铁生锈的必要条件
用方案乙探究空气是铁生锈的必要条件 用方案丙探究不同催化剂对H2O2分解速率的影响
用方案丙探究不同催化剂对H2O2分解速率的影响 用方案丁探究合金及其成分金属的熔点高低
用方案丁探究合金及其成分金属的熔点高低