1.
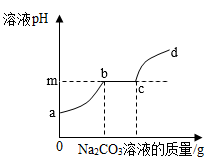
向一定量盐酸和氯化钙的混合溶液中滴加过量的碳酸钠溶液,溶液pH与Na2CO3溶液的质量关系如图所示。则m的值为;bc段发生反应的方程式为。
【考点】
溶液的酸碱性与pH值的关系;
酸碱盐的应用;
基础巩固
能力提升
变式训练
拓展培优
真题演练








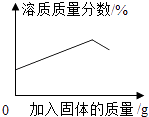 向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化)
向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体(不考虑温度变化)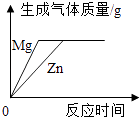 将镁片和锌片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合
将镁片和锌片(均足量)分别和等质量、等溶质质量分数的稀硫酸混合 向pH=10的氢氧化钙溶液中不断加水稀释
向pH=10的氢氧化钙溶液中不断加水稀释 向硫酸铜溶液中加入过量的氢氧化钠溶液
向硫酸铜溶液中加入过量的氢氧化钠溶液